Первичная пластика мочевого пузыря местными тканями при экстрофии у детей
Ю.Э. Рудин, Д.В. Марухненко, Ю.Э. Чекериди
ФГУ "НИИ Урологии Росмедтехнологий", Детская больница Святого Владимира, Москва
Журнал "Экспериментальная и клиническая урология", №1, 2010
Экстрофия мочевого пузыря (ЭМП) - одно из самых тяжелых заболеваний. ЭМП представляет собой сочетание ряда пороков, объединенных единой этиологией дефект мочевого пузыря, уретры, незаращение передней брюшной стенки и порочно сформированные наружные половые органы [1, 2, 3, 4]. ЭМП выявляется у одного на 40 000-50 000 новорожденных и приблизительно в 2-3 раза чаще встречается у мальчиков [5, 6]. Задняя стенка мочевого пузыря выпячивается наружу в виде вентральной грыжи, покрытой слизистой оболочкой [6]. В нижней части экстрофированной площадки находятся устья мочеточников, из которых по каплям выделяется моча. Диастаз лонных и седалищных костей обусловлен недоразвитием их медиальных концов [1, 6, 7]. Непосредственный и постоянный контакт верхних мочевых путей с внешней средой через устья мочеточников способствует развитию хронического пиелонефрита [3, 6, 8].
Диагноз ЭМП чаще всего устанавливают сразу после рождения ребенка [9], хотя заподозрить экстрофию мочевого пузыря можно и внутриутробно [1, 6]: при ультразвуковом обследовании плода на разных стадиях беременности врач должен (хотя бы однократно) увидеть наполненный мочевой пузырь. Отсутствие тени мочевого пузыря при серии обследований должно явиться основанием заподозрить диагноз ЭМП [1, 3, 10, 11]. К сожалению, в нашей стране у врачей женских консультаций отсутствует настороженность по выявлению этого тяжелого порока развития на ранних сроках беременности.
Исследованиями F.D. Stephens, J.M. Hutson (2005) установлено, что причиной возникновения ЭМП является давление хвоста эмбриона (tail) на область урогенитальной диафрагмы (место, где происходит соединение зачатков мочевого пузыря, уретры и полового члена) в период закладки органов на 3-4 неделе внутриутробного развития [1, 10].
Первые операции по коррекции экстрофии были выполнены в середине ХIX века. В 1942 году Янг сообщил об успешном закрытии мочевого пузыря у девочки. Шейка мочевого пузыря в последующие сроки была сформирована в трубку, в результате чего девочка оставалась сухой в течение 3-х часов [1]. Однако большинство хирургов, несмотря на успех этого вида вмешательства, в те годы отдавали предпочтение отведению мочи в кишечник [10, 12].
О необходимости выполнения двусторонней остеотомии подвздошных костей впервые сообщил Шульц в 1954 году, благодаря которой (через 2 недели) удавалось закрыть мочевой пузырь. При этом производилось сближение симфиза. Через неделю после удаления катетера из мочевого пузыря пациентка удерживала мочу [13]. Это наблюдение позволило предположить, что сближение лонных костей с двусторонней подвздошной остеотомией способствует наилучшей функции лонной "петли" и соответственно формирует механизм удержания мочи на уровне урогенитальной диафрагмы [5].
В последние годы первичная пластика мочевого пузыря стала распространенным вмешательством, тогда как отведение мочи в кишечник сопровождается высоким процентом послеоперационных осложнений [1, 3]. В то время у детей, которым выполнялась пластика мочевого пузыря местными тканями без сведения лонных костей, вмешательство часто заканчивалось рецидивом заболевания и отсутствием удержания мочи [11, 14, 15].
Экстрофия мочевого пузыря предполагает длительное этапное лечение. Достигнуть полного удержания мочи у большинства пациентов крайне сложно. Поэтому большое значение имеет успешно проведенный первый этап операции (первичная пластика мочевого пузыря местными тканями, а также соединение и удержание вместе лонных костей, формирование шейки мочевого пузыря и соединение порочных мышц уретрального сфинктера). К сожалению, по данным многих авторов [3-6], добиться полного удержания мочи после первого этапа операции не представляется возможным. И только последующие оперативные вмешательства могут способствовать удержанию мочи [1, 7].
МАТЕРИАЛЫ И МЕТОДЫ
За период с 1988 по 2009 гг. в урологическом отделении Детской больницы Святого Владимира были оперированы 93 ребенка с экстрофией мочевого пузыря в возрасте от 1 суток до 16 лет. Мальчиков (67) было в два с половиной раза больше, чем девочек (26). Большинство пациентов (62) поступали в стационар в первую неделю после рождения.
Всем больным с ЭМП проводились лабораторные анализы (общий анализ крови, с определением времени свертываемости и длительности кровотечения, биохимический анализ крови, группа крови и резус фактор, анализ кала, КЩС, общий анализ мочи).
При клиническом осмотре давалась оценка кожным покровам, определялся тургор мягких тканей, оценивались размеры и степень напряжения большого родничка, состояние пуповины. Измерялись размеры пузырной площадки (длина, ширина), определялось расстояние между устьями мочеточников и расстояние до семенного бугорка, оценивалась степень воспалительных изменений слизистой мочевого пузыря, наличие полипозных разрастаний, определялась способность тканей мочевого пузыря к растяжению и погружению в малый таз. Для уменьшения степени выраженности воспаления слизистой мочевого пузыря поверхность слизистой укрывалась тонкой перфорированной пленкой с антибактериальной мазью. Оценивали размеры полового члена у мальчиков измеряли длину и ширину кавернозных тел, наличие вентральной деформации, определяли положение и размер яичек (рисунок 1).
УЗИ органов мочевыделительной системы и брюшной полости проводилось для исключения сочетанных врожденных пороков развития и для измерения расстояния между лонными костями таза.
Рентгеновский снимок костей таза проводили для измерения исходного диастаза лонных костей и для исключения врожденных пороков крестцово-копчиковой области, подвывихов или вывихов головок бедренных костей.
По показаниям проводились дополнительные методы обследования. При выявлении сочетанных пороков развития экскреторная урография выполнялась 5 больным с признаками расширения ЧЛС и мочеточника. Радиоизотопное обследование назначалось для определения функции почек (23 пациентам). УЗ допплеровское исследование кровотока почки (цветовое картирование) проводили 48 детям для оценки почечного кровотока.
Ирригография, колоноскопия, ректороманоскопия выполнялись тем детям, которым предполагалась пересадка мочеточников в толстую кишку, для оценки длины сигмовидной кишки, состояния слизистой и выбора места имплантации мочеточников.
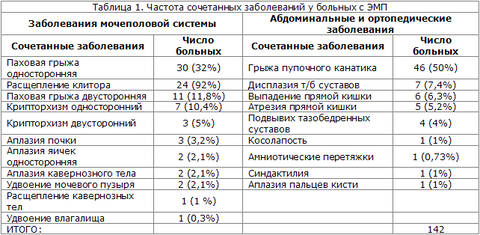
Фистулография выполнялась при наличии ректовагинальных свищей. При обследовании больных с экстрофией мочевого пузыря выявлены различные сочетанные заболевания (таблица 1).
Нами использовались два основных метода коррекции ЭМП: пересадка мочеточников в кишку и первичная пластика мочевого пузыря местными тканями. Для проведения объективной оценки результатов оперативного лечения экстрофии мочевого пузыря были выделены две группы.
В I группу пациентов вошли дети (12 чел.), которым выполняли иссечение площадки мочевого пузыря с пересадкой мочеточников в толстую кишку. Большинство детей этой группы (8 чел., 66%) оперированы по Гудвину (пересадка мочеточников в сигмовидную кишку с антирефлюксной защитой). Пересадка мочеточников в полуотключенный сегмент сигмовидной кишки выполнена 4 больным (34%). Эти оперативные вмешательства выполнялись в период с 1988 по 1998 гг. В последующие годы предпочтение отдавалось первичной пластике мочевого пузыря с остеотомией подвздошных костей.
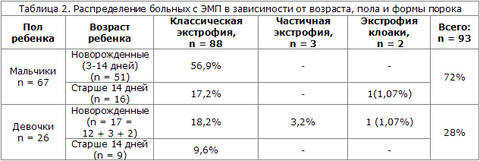
Основную II группу составили пациенты (81), которым проведена первичная пластика мочевого пузыря местными тканями с пластикой шейки и со сведением костей лонного сочленения. Распределение больных с экстрофией мочевого пузыря в зависимости от возраста, пола и формы порока представлено в таблице 2.
С 1997 по 2009 годы мы стали использовать международный протокол ведения больных с экстрофией мочевого пузыря. Операция первичная пластика мочевого пузыря местными тканями предусматривала проведение следующих этапов:
выделение и мобилизация стенки мочевого пузыря;
формирование шейки пузыря;
дренирование почек уретеростомами;
выведение и фиксация мочеточниковых катетеров и эпицистостомы;
ушивание мочевого пузыря;
сведение и фиксация лонных костей в области лонного сочленения;
ушивание шейки мочевого пузыря;
ушивание дефекта передней брюшной стенки.
Оптимальным сроком для выполнения операции считается возраст 3-5 сутки после рождения ребенка. Чем старше был ребенок, тем сложнее удавалось сопоставить и фиксировать кости таза в области лонного сочленения. Детям старше 14 дней (17 человек, средний возраст 4 мес.) и новорожденным с большим расстоянием между лонными костями более 5 см (6 чел.) для надежного сопоставления лонных костей проводился один из вариантов подвздошной остеотомии. Всего выполнено 23 операции на костях таза.
Задняя вертикальная подвздошная остеотомия была выполнена 3 (13%) больным: подвздошные кости выделяли через задние вертикальные разрезы в проекции крестцово-подвздошного сочленения. Обе пластинки подвздошной кости пересекали долотом от S заднего подвздошного гребня к седалищной вырезке, на 5-7 мм латеральнее крестцово-подвздошного сочленения.
Операция Хиари выполнена 9(39%) детям, а надацетобулярная остеотомия (операция Вильсона) 11(48%) детям, среди них трем новорожденным с большим расстоянием между лонными костями и маленькой площадкой мочевого пузыря. Данные операции обладают рядом преимуществ и более удобны, поскольку и остеотомия, и пластика мочевого пузыря осуществляется в положении ребенка на спине, и его не нужно переворачивать во время выполнения оперативного вмешательства. Иммобилизацию у новорожденных детей осуществляли вытяжением по Блаунту в течение 3-х недель. Детям старше 2-х месяцев накладывали кокситно-гипсовую повязку на 1 мес. Детям старше 1 года фиксацию костей проводили с использованием стержневых аппаратов сроком до 1,5 мес. Ортопедический этап операции выполняли ортопеды-травматологи.
Типичная операция пластики мочевого пузыря местными тканями была выполнена 25 больным (26,8%). На основании накопленного опыта предложена модификация существующей методики: проводили глубокое выделение тканей в области шейки мочевого пузыря с отделением их от лонных костей и пересечением мышц урогенитальной диафрагмы; формировали шейку из ткани мочевого пузыря путем иссечения треугольных лоскутов слизистой оболочки и сшивания их в трубку по методу "двойного запахивания". Нами предложен также оригинальный шов, соединяющий кости лонного сочленения: вместо внутрикостного шва применяли циркулярный шов вокруг верхней ветви лонной кости. Узел данного шва завязывали снаружи, что предупреждало в дальнейшем стенозирование шейки мочевого пузыря. Данная операция проведена у 56 больных.
РЕЗУЛЬТАТЫ ЛЕЧЕНИЯ
Ранние послеоперационные осложнения у детей I группы (пересадка мочеточников в кишку)
В результате несостоятельности анастомоза у 2-х детей (16,6%) в послеоперационном периоде развился мочевой перитонит, что потребовало выполнения повторной операции: ушивание дефекта, дренирование брюшной полости. В последующие сроки у одного ребенка (8,3%) образовался наружный мочевой свищ. Ушивание свища успешно проведено через 8 мес. после первой операции, у второго получен удовлетворительный результат. Обострение пиелонефрита с подъемом температуры до 38°С отмечено у 3-х больных (25%).
С целью декомпрессии кишечника этим детям устанавливали газоотводную трубку. Проводилась инфузионная и антибактериальная терапия. Воспаление удавалось купировать. Закрыть дефект передней брюшной стенки с хорошим косметическим результатом не удавалось без сведения костей лонного сочленения. Расхождение краев операционной раны было отмечено у четырех детей (33%). Заживление осуществлялось вторичным натяжением, что в дальнейшем потребовало повторной операции.
Пластика передней брюшной стенки треугольными кожно-апоневротическими лоскутами позволила улучшить косметический результат, однако длина полового члена (не более 7 см в 15 лет) и выраженные рубцы в лонной области не позволили назвать данный косметический результат хорошим ни у одного больного.
Ранние послеоперационные осложнения у детей II основной группы (первичная пластика мочевого пузыря местными тканями)
Прорезывание нити, фиксирующей кости лонного сочленения, отмечено у 6 детей (7,4%), что привело к частичному расхождению швов на передней брюшной стенке. Несостоятельность швов шейки мочевого пузыря выявлена у 2-х пациентов (2,5%), что ухудшило удержание мочи в послеоперационном периоде. Рецидив экстрофии, т.е. полное расхождение швов мочевого пузыря и передней брюшной стенки наблюдали у 4-х больных (4,9%). У всех этих детей до операции отмечался значительный диастаз лонных костей (более 4-х см). Одновременно с этим имелась небольшая по размерам (< 3,0 см) площадка мочевого пузыря (рисунок 1).
Во время операции удавалось хорошо сопоставить лонные кости, ушить мышцы передней брюшной стенки и края кожной раны. Но достаточно сильная обратная тяга костей таза приводила в дальнейшем к прорезыванию, а иногда и разрыву нити, фиксирующей лонное сочленение.
Всем детям через 8-14 мес. были выполнены повторные операции, дополненные надацетабулярной остеотомией с хорошим результатом. В последние 3 года нами были расширены показания для проведения надацетабулярной остеотомии (23 наблюдения).
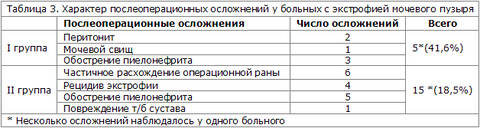
Осложнения остеотомии в виде повреждения тазобедренного сустава наблюдали лишь у одного ребенка (4,3%). Консервативная терапия была успешна. Тяжелое обострение пиелонефрита с подъемом температуры тела наблюдали у 5 больных (6,2%). Обострение купировали антибактериальной терапией и установкой уретрального катетера. Двоим детям (2,4%) потребовалось стационарное лечение с проведением антибактериальной (в/в и в/м) и инфузионной терапии (таблица 3).
Отдаленные результаты лечения экстрофии мочевого пузыря
Отдаленные результаты лечения экстрофии мочевого пузыря прослежены у 89 (95,7%) детей в сроки от 6 мес. до 18 лет после операции. Во II (основной) группе обследовано 79 (97,5%) больных, а в I группе 10 (83,3%). Полученные результаты лечения условно были разделены на 3 группы: хорошие, удовлетворительные, неудовлетворительные.
Оценку результатов проводили по следующим критериям:
показатели функции почек оценивались после операции по данным радиоизотопного исследования, биохимического анализа крови, клиренса эндогенного креатинина, СКФ (скорость клубочковой фильтрации);
признаки нарушений уродинамики (расширение ЧЛС почек и мочеточников) по данным УЗИ и экскреторной урографии;
частота эпизодов обострения пиелонефрита с подъемом температуры, подтвержденные на УЗИ (эхо-признаки пиелонефрита), воспалительные изменения анализов крови и мочи;
мочекаменная болезнь;
наличие удержания кала, мочи;
косметические результаты операций (диастаз лонных костей, внешний вид половых органов, размеры полового члена, выпадение влагалища и матки).
Результаты в I группе
Хорошие результаты в I группе получены у 4 (33%) больных:
заживление раны первичным натяжением, без образования мочевого свища;
стабильные показатели функции почек, отсутствие нарушений уродинамики;
частота эпизодов обострения вторичного пиелонефрита с подъемом температуры не чаще одного раза в год, подтвержденные на УЗИ;
раздельный акт мочеиспускания и дефекации. Наличие удержания кала и мочи.
Удовлетворительные результаты I группы получены у 4 пациентов (33%):
снижение функции почек средней и среднетяжелой степени по данным радиоизотопного исследования, I-II степень почечной недостаточности констатировано у 4(33%) человек; также отмечены умеренные признаки нарушения
уродинамики по данным экскреторной урографии и радиоизотопного исследования;
обострения пиелонефрита возникали не чаще 2-3 раз в год, а развитие мочекаменной болезни, не приведшей в дальнейшем к потере функции почек у одного больного (10%);
частичное недержание кала и мочи определено у 4-х пациентов (33%); специфический неприятный запах мочи, смешанной с калом, создавал социальные проблемы у данной группы пациентов;
выпадение влагалища и матки.
Неудовлетворительные результаты I группы констатировали у 4-х больных (33%):
Основным критерием явилось развитие III степени хронической почечной недостаточности у 4 человек (33%).
Газовый и каловый рефлюкс являлись причиной обострения S пиелонефрита, что в свою очередь вело к развитию нефросклероза и прогрессированию ХПН.
Нефрэктомия была выполнена двум детям. Первому из них удалена вторично сморщенная почка в связи с развитием нефрогенной гипертонии. У другого нефрэктомия выполнена после очередного обострения пиелонефрита, которое осложнилось пионефрозом на фоне прогрессирования мочекаменной болезни (образование коралловидного камня).
Результаты во II группе
Хорошие результаты определены у 65 человек (80,2%):
отсутствие нарушения функции почек, уродинамики и обострений пиелонефрита;
постепенный рост мочевого пузыря достижения объема более 80,0 мл к 1,5-2 катамнестическим годам; отсутствие стеноза сформированной шейки мочевого пузыря и уретры, свободная катетеризация уретры катетером возрастного размера (рисунки 2-6);
удержание костей лонного сочленения или расхождение последних на незначительное расстояние не более 1-1,5 см;
частичное удержание мочи отмечено у 65 детей (80,2%), больные мочились порциями, 23 ребенка (28,3%) оставались сухими на протяжении 30 минут и более.
Удовлетворительные результаты II группы выявлены у 10 пациентов (12,3%):
отсутствие нарушений функции почек и уродинамики, без обострений пиелонефрита;
частичное расхождение костей лонного сочленения, 1,5-3 см, с расхождением шейки мочевого пузыря у 8 детей (9,8%);
признаки умеренного стеноза шейки мочевого пузыря последняя пропускает катетер на 1 Ch (Шарьер) меньше возрастного диаметра, диагностированы у 2 пациентов (2,4%).
Неудовлетворительные результаты II группы определены у 6 детей (7,4%):
снижение функции почек средней степени по данным радиоизотопного исследования и почечная недостаточность I-II степени (СКФ) выявлены у 2 детей (2,4%);
умеренные нарушения уродинамики вследствие стеноза шейки мочевого пузыря с редкими обострениями пиелонефрита (не чаще 1-2 раз в год) отмечены у 2-х больных (2,4%), повторными операциями устранены явления стеноза;
рецидив экстрофии мочевого пузыря вследствие расхождения костей лонного сочленения (разрыв или прорезывания нитей, фиксирующих лонные кости) наблюдали у 4 детей (4,8%), выполнены повторные операции с благоприятным результатом, четверых из них удалось перевести в группу больных с удовлетворительными результатами.
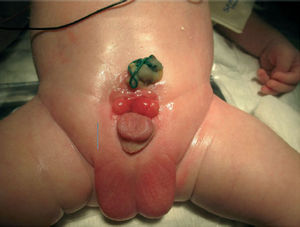
Рисунок 1. Ребенок Ю. 2 дней жизни до операции. Размер пузырной площадки 2,3 см
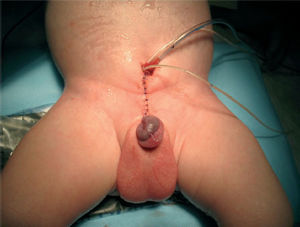
Рисунок 2. Больной Ю. после операции
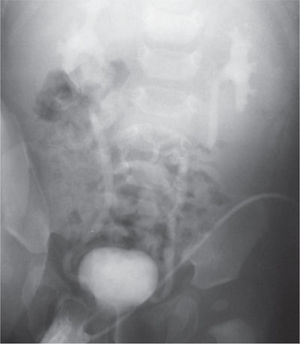
Рисунок 3. Больной Ю. Имеется 2-сторонний ПМР 2-3 степени. Объем мочевого пузыря 30 мл. Мочится порциями. Сухой промежуток 15 минут
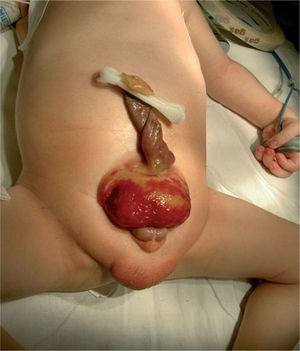
Рисунок 4. Больной Д. 3-х суток жизни, размер пузырной площадки 5,5 см
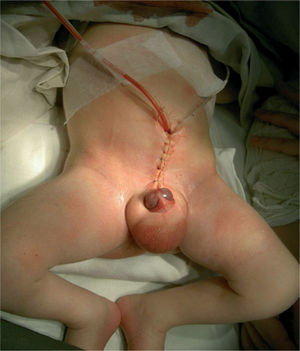
Рисунок 5. Больной Д. после операции
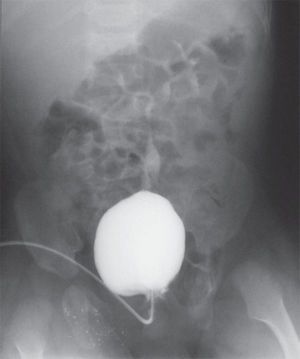
Рисунок 6. Цистограмма больного Д. через 1,5 года после операции. Имеется ПМР 2-3 степени слева. Объем мочевого пузыря 70 мл. Мочится порциями. Сухой промежуток 30 минут
ПУЗЫРНО-МОЧЕТОЧНИКОВЫЙ РЕФЛЮКС (ПМР)
Мы не относим пузырно-мочеточниковый рефлюкс, выявленный у детей с ЭМП в послеоперационном периоде, к осложнениям оперативного метода лечения, так как недоразвитие интрамурального отдела мочеточника является осложнением непосредственно самого заболевания экстрофии мочевого пузыря. При контрольном обследовании ПМР обнаружен у 54 (66,6%) детей. Коррекция проводилась, путем эндоскопического введения коллагена, ДАМ+, уродекса (urodex) под устье мочеточника. У 31 (57,1%) получены положительные результаты после первого введения коллагена. У 19 (35,1%) детей коллагенизация повторялась до 4 раз с положительным результатом. Четырем детям (7,4%) в последующие годы выполнена антирефлюксная операция по Коэну.
МОЧЕКАМЕННАЯ БОЛЕЗНЬ
Конкременты мочевого пузыря выявлены у 15 детей II группы (18,5%). У 9 из них камни были удалены или разрушены эндоскопически. Из-за несоответствия размеров литодестрактора и шейки мочевого пузыря двум больным была произведена цистолитотомия. Конкременты свободно располагались в просвете мочевого пузыря только у 4-х пациентов, у остальных (11 чел.) камни были фиксированы на нитях к лонным костям. Нити постепенно смещались вниз и частично прикрывали просвет мочевого пузыря. Удаление конкрементов не повлияло на функциональный результат лечения ни у одного больного.
ОБСУЖДЕНИЕ
Таким образом, в I группе больных с экстрофией мочевого пузыря, которым выполнялось иссечение пузырной площадки и отведение мочи в толстую кишку, хорошие результаты выявлены у 4-х пациентов (33%) (троим из них была проведена пересадка мочеточников в полуизолированный сегмент сигмовидной кишки). Дети имели раздельный акт мочеиспускания и дефекации. Отсутствовали нарушения азотовыделительной функции. У 6 детей (50%) наблюдались частые обострения пиелонефрита и различная степень нарушения функции почек (III степень ХПН) с частичным недержанием кала и мочи. Все дети имели неудовлетворительные косметические результаты.
Во II группе хорошие и удовлетворительные результаты констатированы у 75 больных (92,5%). Все дети имели мочевой пузырь, объем которого был различен. Большой объем мочевого пузыря (80-160 мл) выявлен у 23 больных (28,3%) (рисунки 4-6), у 41 больного (50,6%) объем пузыря составил 40-80 мл. У остальных пациентов имелся объем мочевого пузыря в пределах 25 мл. У половины детей II группы после первой операции констатировано удержание мочи. Часть детей (28%) оставались сухими в течение 30 мин. и более. Создание механизма удержания мочи предусматривает в последующем этапное лечение планируется проведение пластики полового члена и уретры, а затем повторной пластики шейки мочевого пузыря. В подростковом возрасте возможен вариант увеличивающей объем пластики мочевого пузыря участком тонкой кишки.
ЗАКЛЮЧЕНИЕ
Применение классической методики операции пластики мочевого пузыря местными тканями со сведением костей лонного сочленения позволяет улучшить результаты лечения больных с экстрофией мочевого пузыря.
Наибольший процент хороших результатов операции достигнут у больных с большими размерами пузырной площадки (50 мм и более), оперированных на первой недели жизни ребенка.
Сведение лонных костей является обязательным для всех больных с этим заболеванием, позволяющим улучшать удержание мочи, увеличить объем мочевого пузыря, удлинить размеры полового члена за счет сближения кавернозных тел, а также упростить проведение пластики дефекта передней брюшной стенки.
Применение циркулярного шва для фиксации лонных костей со смещением прямых мышц живота обеспечивает лучшее удержание мочи в последующие сроки.
Первичная пластика мочевого пузыря у детей старше 14 дней, а также с большим диастазом лонных костей и малыми размерами пузырной площадки предусматривает проведение одного из вариантов остеотомии.
ЛИТЕРАТУРА
1. Ашкрафт К У. Детская хирургия. СПб. ООО "Раритет-М". 1999. С. 1128.
2. Баиров Г А. Хирургия пороков развития у детей. Л 1968. C 231-239.
3. Державин В.М., Казачков С.А., Банников ВМ. // Урология и нефрология. 1989. № 5. С. 24-27.
4. Лопаткин Н А., Пугачев А.Г. Руководство. М Медицина. 1986. С. 207211.
5. Лопаткин Н А., Пугачев АГ., Алферов С.И. // Урология и нефрология. 1994. № 1. С. 39-41.
6. Лопаткин Д. А., Шевцов И П Оперативная урология. Руководство для врачей. Л 1986. C 136-142.
7. Осипов И Б. Реконструктивно-пластические операции при экстрофии мочевого пузыря у детей: Автореф. дисс. докт. мед. наук. СП. 1996.
8. Осипов И Б., Казачков С.А. и др.// Урология и нефрология. 1996. № 5. С. 21-23.
9. Шуваев А. В. Обоснование дифференцированной тактики оперативного лечения недержания мочи при эписпадии и экстрофии мочевого пузыря у детей: Автореф. дисс. канд. мед. наук. М 1997.
10. Рудин Ю. Э. Эписпадия и экстрофия мочевого пузыря. Урология. Национальное руководство. / Под ред.Н.А. Лопаткина. М ГЕОТАР Медиа. 2009. С. 273-293.
11. Gearhart J.P., Jeffs R.D: The failed exstrophy closure: Evaluation and management. //J Urol. 1991. Vol. 146. № 1082. P. 135-139.
12. Lattimer J.K., Beck L., Yeaw S. et al. Long-term follow-up after exstrophy closure: Late im provement and good quality of life.// J Urol. 1978. Vol. 119. P.664-666.
13. Shultz W.G: Plastic repair of exstrophy of bladder combined with bilateral osteotomy of ilia. //J Urol. 1958.Vol. 79. P.453-458.
14. Nelson Caleb P. Dialogues in Pediatric Urology. Dec. 2007. № 2. Р 2 34241.
15. Ramseyer Pascal and Peter Frey, Dialogues in Pediatric Urology. Dec. 2007. № 2. P. 212-216.
- Подпись автора
Не спрашивай, по ком звонит колокол: он звонит по тебе © (Джон Донн)